Data aktualizacji: 14 października, 2024
Zidentyfikowanie fundamentalnej roli peptydów w procesie przywracania integralności oraz regeneracji skóry czy poprawie syntezy kolagenu wywołało rewolucję w dziedzinie kosmetologii. Te naturalne przekaźniki, pełniące funkcję aktywatorów odpowiedzi komórkowej i sygnalizacji, zdobyły niezwykłe uznanie wśród profesjonalistów i entuzjastów branży kosmetycznej. Ich zastosowanie stało się kluczowym elementem nowoczesnych strategii pielęgnacyjnych, a popularność peptydów jako składników kosmetyków ciągle rośnie, wzmacniając ich pozycję w dziedzinie innowacyjnych rozwiązań dla zdrowia i urody skóry.
Podstawy biochemiczne peptydów
Peptydy to organiczne związki chemiczne, które kształtują się poprzez złączenie co najmniej dwóch do maksymalnie stu cząsteczek aminokwasów w łańcuchy przy użyciu wiązań peptydowych. Aminokwasy stanowią fundamentalny składnik budulcowy skóry, pełniąc istotną rolę w różnorodnych procesach zachodzących w tym narządzie, takich jak związane z wiązaniem wody, utrzymaniem odpowiedniego nawilżenia skóry, produkcją kolagenu oraz ochroną, regeneracją i odnową komórek skóry.
Proces tworzenia peptydów wynika z kondensacji grupy karboksylowej jednego aminokwasu z grupą aminową drugiego. Każdy łańcuch peptydowy wykazuje dwa przeciwległe końce. Jeden z końców, nazwany „końcem N”, zawiera wolną grupę aminową NH2, natomiast na drugim końcu znajduje się grupa COOH, określana jako „koniec C”.
Działanie peptydów
Ze względu na wysokie podobieństwo peptydów do podstawowych składników budulcowych wszystkich organizmów żywych oraz ich niewielkiego rozmiaru, mogą przenikać do głębszych warstw skóry. Stymulują przez to podział komórek macierzystych, zwiększając ich aktywność i zdolność do regeneracji. Peptydy uczestniczą w komunikacji komórkowej, utrzymaniu gospodarki białkowej, a także proliferacji komórkowej, migracji, przebiegu procesów zapalnych, angiogenezie i melanogenezie. Regulują przez to procesy obronne, reakcje odpornościowe, odpowiedź na stres oraz zachowanie homeostazy wewnątrzustrojowej.

Peptydy
Peptydy
Peptydy są jednym z najważniejszych składników w zaawansowanej pielęgnacji skóry i włosów. W składzie mają niewielkie łańcuchy aminokwasów, które są podstawowymi budulcami białek takich jak kolagen, elastyna i keratyna. To czyni je niezwykle istotnymi w kontekście kosmetycznym, gdzie są wykorzystywane do rozwiązywania wielu problemów skóry i włosów, począwszy od starzenia się, a na trądziku i pigmentacji kończąc.
To, co czyni peptydy tak wyjątkowymi, to ich wszechstronność i zdolność do działania na różnych płaszczyznach. Są nie tylko istotne dla zdrowia i wyglądu skóry i włosów, ale również odgrywają kluczową rolę w produktach do pielęgnacji skóry wokół oczu, poprawiając mikrokrążenie i zapobiegając utracie elastyny.
Wraz z wiekiem spada nie tylko ilość naturalnych peptydów w organizmie, ale także ich właściwa synteza, co powoduje stopniowe osłabianie i zakłócenie regulacji procesów naprawczych i metabolicznych, związanych ze zmianami w pierwszorzędowej strukturze peptydów. Aktywność czynników mutagennych, przyspieszających procesy destrukcyjne, może prowadzić do całkowitej modyfikacji lub utraty aktywności biologicznej danego peptydu. Nawet pojedyncza zamiana aminokwasu w peptydzie zbudowanym z sekwencji 50 lub więcej aminokwasów może znacząco zmniejszyć lub całkowicie znieść jego aktywność biologiczną, co może prowadzić do potencjalnie poważnych konsekwencji dla całego organizmu.
Peptydy biomimetyczne
Szczególnym zainteresowaniem we współczesnym przemyśle kosmetycznym cieszą się peptydy biomimetyczne reprezentujące syntetyczne związki chemiczne, działające na zasadzie precyzyjnego naśladowania naturalnych substancji regulujących procesy metaboliczne, oddziałują bezpośrednio na komórki docelowe. Znaczący wpływ na biodostępność peptydów oraz ich ukierunkowane i selektywne działanie wykazują tzw. sekwencje sygnałowe, czyli łańcuchy kilku aminokwasów które lokalizują się na końcach cząsteczek i wykazują powinowactwo wobec konkretnego receptora wbudowanego w błonę komórkową docelowej komórki. Taka konstrukcja peptydów umożliwia ich oddziaływanie nawet przy niewielkich dawkach, precyzyjnie w miejscu, gdzie zamierzamy wywołać zmiany biochemiczne komórek organizmu. Otwiera to ogromne perspektywy w kontekście dalszych badań, mających na celu opracowanie substancji o specyficznym i celowanym oddziaływaniu na procesy metaboliczne komórek skóry oraz zahamowanie procesów starzenia się.
Peptydy sygnałowe
Peptydy sygnałowe skonstruowane są z kilku do kilkudziesięciu reszt aminokwasowych, połączonych ze sobą wiązaniem peptydowym. Ze względu na efekt oddziaływania, literatura wyróżnia w pierwszej kolejności peptydy sygnałowe. Wykazują zdolność do inicjowania procesów wewnątrzkomórkowych. Stanowią najczęściej fragment kolagenu, utrzymującego odpowiednią wilgotność skóry i elastyny nadającej skórze sprężystość i elastyczność. Są wbudowywane w procesie biosyntezy tych białek. Peptydy sygnałowe pobudzają pracę fibroblastów, aktywują syntezę kwasu hialuronowego w skórze oraz hamują aktywność metaloproteinaz w keratynocytach. Molekularny mechanizm działania różnych typów peptydów sygnałowych odzwierciedlają ich właściwości, skoncentrowane między innymi na hamowaniu procesów starzenia.
Wśród peptydów sygnałowych wykazujących aktywność anti-aging, wyróżnia się:
Oligopeptide-20
Złożony z 12 aminokwasów; skoncentrowany na pobudzaniu fibroblastów, zwiększając produkcję kolagenu i kwas hialuronowego.
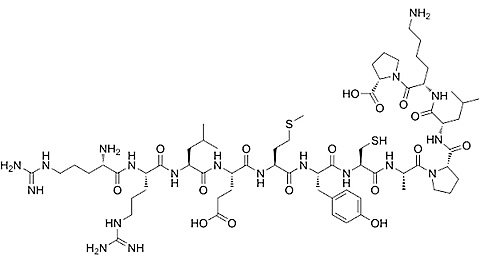
Palmitoyl tripeptide-3/5
Swoim działaniem naśladuje aktywność tripeptydu trombospondyny I, sprzyjając tworzeniu kolagenu za pośrednictwem TGF-β.
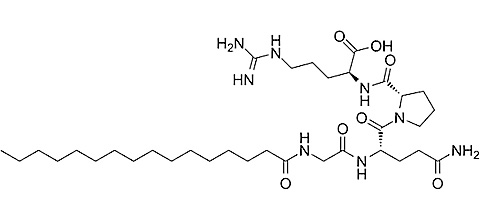
Pal-KTTKS (Palmitoyl Pentapeptide-4)
Fragment prokolagenu I; aktywuje fibroblasty do produkcji kolagenu I i III, a także stymuluje produkcję fibronektyny i elastyny. W komercyjnych zastosowaniach Pal-KTTKS jest modyfikowany kwasem palmitynowym, co zwiększa jego aktywność oraz potencjał penetracji do głębszych warstw skóry.
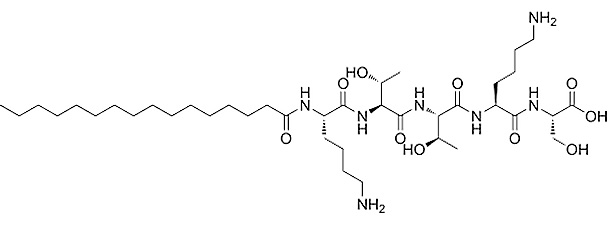
Pal-KT (Palmitoyl-Lysine-Threonine)
Jeden z najkrótszych peptydów; zwiększa różnicowanie naskórka, wpływając na strefę błony podstawnej, pobudza fibroblasty, zwiększa syntezę kolagenu I, kolagenu IV i fibronektyny.
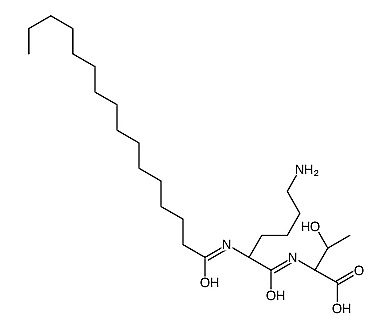
T10-C (Cytrulina tripeptyd-10)
Złożona z sekwencji dekorinu; zwiększa liczbę włókien kolagenowych oraz poprawia ich strukturę. Głównym celem jego działania jest kontrolowanie jednolitości włókien kolagenowych oraz regulacja ich wzrostu.
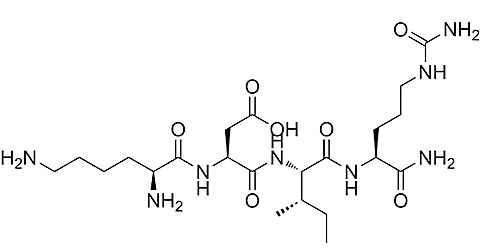
Heksapeptyd: val-gly-val-ala-pro-gly – stymulacja proliferacji fibroblastów skórnych; pośrednictwo w regulacji aktywności metaloproteinaz (MMP-1,-3) w aktywnych stanach zapalnych skóry.
Peptydy transportujące
Kolejny rodzaj peptydów biomimetycznych stanowią peptydy transportujące, skoncentrowane na transporcie substancji niezbędnych do prawidłowego przebiegu procesów metabolicznych zachodzących w skórze, tj. jony metali (Cu, Mn). Szczególnie kluczowa wydaje się być jony miedzi, od których zależna jest oksydaza lizylowa, niezbędny w tworzeniu kolagenu i elastyny enzym.
Tripeptyd glicylo-L-histydylo-L-lizyna (GHK)
Jednym z peptydów transportujących jony miedzi jest tripeptyd glicylo-L-histydylo-L-lizyna (GHK), pobudzający syntezę kolagenu przez fibroblasty, wspomagając przez to przebudowę tkanek skóry.
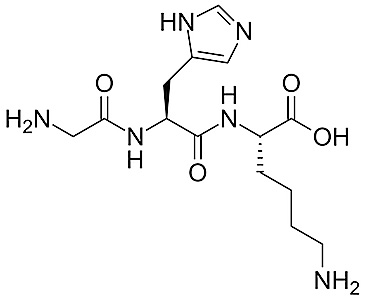
Pierwsza synteza GHK z ludzkiego osocza miała miejsce w 1973 r., natomiast jego właściwości regeneracyjne zaobserwowano w 1985 r., co znacznie wpłynęło na popularność GHK w branży produktów kosmetycznych. Wyniki badań prowadzonych na modelu fibroblastów ludzkich wykazały, że kompleks miedź-peptyd zwiększa syntezę kolagenu typu I i glikozaminoglikanów. Ponadto GHK w korelacji z miedzią stymuluje działanie metaloproteinaz I i II, wpływając skutecznie na usuwanie uszkodzonych form włókien kolagenowych i elastynowych z pozakomórkowej matrycy, pobudzając jednocześnie syntezę nowych fibroblastów.
Peptyd GHK jest też nierzadko zaliczany do peptydów sygnałowych ze względu na zdolność do degradacji dużych agregatów kolagenowych powstałych w bliznach oraz stymulację syntezy kolagenu, elastyny, proteoglikanów i glikozaminoglikanów, jednak uważa się, że jego główne działanie opiera się na transporcie miedzi do skóry. Z tą właściwością wiąże się też inna funkcja tego peptydu, polegająca na neutralizowaniu wolnych rodników. Cały proces opiera się wówczas na aktywności katalazy oraz dysmutazy nadtlenkowej wobec kofaktora, którym jest miedź.
Peptydy transportujące bogate w argininię
Badania skoncentrowane na analizie mechanizmów funkcjonowania peptydów transportujących pozwoliły scharakteryzować znaczenie innej grupy związków, którymi są peptydy bogate w argininię, gdzie obecność aminokwasu znacząco ułatwia wewnątrzkomórkowy transport różnych białek do komórek. Obecność argininy w strukturze peptydów transportujących pozwala wykorzystać tą cząsteczkę jako miejscowe i przezskórne nośniki substancji leczniczych.
Właściwości silnej penetracji warstw skóry wykazuje także peptyd PEP-1, którego zadaniem jest transport białka rybosomalnego S3 (rpS3), posiadającego silne właściwości przeciwstarzeniowe. Dostarczenie takich substancji z zewnątrz do skóry właściwej działa jako bodziec do produkcji nowych makromolekuł kolagenu, co z kolei przyczynia się do poprawy wyglądu i elastyczności skóry.
Niezwykle istotną, a jednocześnie jedną z popularniejszych grup w branży kosmetycznej stanowią inhibitory neurotransmiterów. Aktywność związków tej grupy opiera się na blokowaniu działania neuroprzekaźników połączenia nerwowo-mięśniowego. Dochodzi do przeciwdziałania nadmiernym skurczom fibroblastów poprzez zahamowanie wydzielania neurotransmiterów, tj. acetylocholina. Prekursorem tej grupy jest toksyna botulinowa, która jest od lat stosowana w medycynie estetycznej. Działanie toksyny botulinowej polega na łączeniu z płytką mięśniowo-nerwową, co skutkuje porażeniem skurczu mięśni. Formowanie nowych zakończeń nerwowo-mięśniowych i regeneracja przekazywania impulsów następuje stopniowo. Nietoksycznym odpowiednikiem toksyny botulinowej jest heksapeptyd, o wzorze N-terminalnego końca białka SNAP-25 (Ac-Glu-Glu-Met-Gln-Arg-Arg-NH2), popularny pod nazwą argirelina.
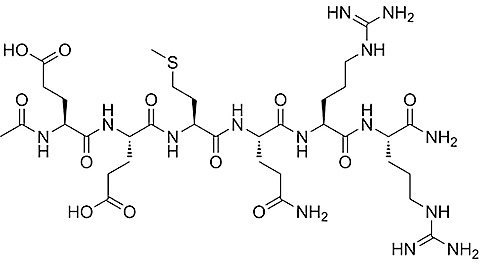
Działanie argireliny skupia się na inhibicji acetylocholiny, blokując impulsy w obrębie płytki nerwowo-mięśniowej oraz zapobiegając działaniu białek transbłonowych SNARE, zaangażowane w fuzję pęcherzyków synaptycznych z błoną komórkową. Na popularność w branży kosmetycznej i medycynie estetycznej niezwykle wpłynęła stabilność termiczna tego peptydu.
Badania naukowe wskazują, że synergistyczne działanie w stosunku do argireliny wykazuje Pentapeptide-18 (Gly-Pro-Arg-Ala-NH2). Aktywność tej cząsteczki polega na hamowaniu aktywności neuronów oraz katecholamin. Kolejnym pentapeptydem, złożonym z pięciu reszt aminokwasowych jest Pentapeptide-3, należący do grupy antagonistów receptorów acetylocholiny, blokując kanały sodowe na błonie synaptycznej, zmniejszając ilości uwalnianych jonów sodu oraz częstości skurczu mięśni. Strukturalnie krótszym przedstawicielem inhibitorów neurotransmiterów jest natomiast Tripeptide-3, występujący w roli antagonisty mięśniowego receptora nikotynowego acetylocholiny i blokujący receptor nikotynowy mięśni.
Inhibitory enzymów
Ostatnim rodzajem peptydów są związki pozyskiwane z naturalnego wyciągu z gruczołu jedwabnego Bombyx mori hamujące w sposób pośredni i bezpośredni działanie enzymów. Początkowo peptydy jedwabiu uważane były za zanieczyszczenia wywołujące szkodliwą produkcję cytokin prozapalnych, jednak prowadzone badania naukowe jednoznacznie wskazały na właściwości przeciwutleniające peptydowych inhibitorów enzymów z wysokim powinowactwem do chelatowania miedzi. Co więcej, wyciąg z gruczołu jedwabnego Bombyx mori hamuje peroksydacje lipidów oraz apoptozę keratynocytów.
Kolejnym związkiem hamującym aktywność enzymów są peptydy soi, które w swoim składzie posiadają duże ilości izoflawonoidów wykazujące działanie przeciwzapalne i antyoksydacyjne. Bezpośrednie zastosowanie ekstraktu sojowego na skórę poddaną promieniowaniu ultrafioletowemu skutkuje zwiększoną aktywnością katalazy. Mechanizm działania tego enzymu polega na przekształcaniu nadtlenku wodoru w wodę i tlen, przy jednoczesnej inhibicji konwersji do reaktywnych form tlenu wewnątrzkomórkowego. Ponadto, po ekspozycji na promieniowanie UV, obserwuje się wzrost ekspresji cyklooksygenazy (COX), enzymu biorącego udział w produkcji prozapalnych prostaglandyn. Peptydy pozyskiwane z naturalnego wyciągu z nasion soi, hamują działanie enzymów proteaz serynowych pośredniczących w fagocytozie melanosomów przez keratynocyty, co jest szeroko wykorzystywane w leczeniu hiperpigmentacji skóry. Peptydy sojowe, ze względu na swoje właściwości są wykorzystywane jako substancje działające silnie przeciwstarzeniowo, nawilżająco czy przeciwsłonecznie.
Innym przykładem naturalnych peptydów charakteryzowanych jako inhibitory enzymów są związki pochodzenia ryżowego znane ze swych właściwości antyoksydacyjnych i poprawiających kondycję macierzy zewnątrzkomórkowej (ECM). Mają one również zdolność do hamowania aktywności metaloproteinaz w keratynocytach oraz do aktywacji syntezy kwasu hialuronowego w skórze. Ciekawe właściwości wykazuje także oligopeptyd acetyl tetrapeptide-5, którego aktywność polega na hamowaniu glikacji, czyli niszczeniu przez cukry głównych białek podporowych skóry, tj. kolagen oraz zwiększeniu przepuszczalności naczyń.
Podsumowanie
Podsumowując, peptydy to łańcuchowe związki chemiczne złożone z aminokwasów połączonych ze sobą wiązaniami peptydowymi. Ich źródłem są rośliny, jednak mogą stanowić także produkt przemysłu biotechnologicznego. Głównym zadaniem peptydów jest naśladowanie funkcji naturalnych peptydów występujących w organizmie człowieka, przez co określa się je mianem peptydów biomimetycznych. Pomimo obecności w swojej strukturze takich samych aminokwasów jak białka, cząsteczki peptydów są dużo mniejsza, dzięki czemu skutecznie przenikają przez warstwę rogową naskórka, co wpłynęło na szerokie spektrum zastosowania peptydów w branży kosmetycznej i medycynie estetycznej. Udowodniono, że peptydy kosmetyczne:
- posiadają naturalną „technologię” zwiększającą nawilżenie skóry,
- poprawiają elastyczność, teksturę i nawilżenie skóry i włosów,
- skutecznie hamują proces starzenia, wpływając na elastyczność włókien kolagenowych.
Literatura:
- Gorouhi F., Maibach H.I., Role of topical peptides in preventing or treating aged skin. Internation Journal of Cosmetic Science; 2009, 31, 327-345.
- Lupo M.P., Cole A.L.: Peptydy i białka. Kosmeceutyki, pod red. Draelos Z.D., Wydawnictwo Elsevier Urban & Partner, 2012.
- Sadick N., Cosmeceuticals. Journal of Drugs in Dermatology; 2003, 2, 529–537.
- Murray, K.R., Granner K.D., Mayes P.A., Rodwell W.V.: Biochemia Harpera, Wydawnictwo PZWL, Warszawa 1995.
- Konarska L.: Molekularne mechanizmy przekazywania sygnałów w komórce, Wydawnictwo Naukowe PWN, Warszawa 2007.
- Arct J., Chmielewski R.: Niskocząsteczkowe biologicznie czynne peptydy w kosmetyce. Przełom w substancjach czynnych czy chwyt marketingowy?, Wykład, Wyższa Szkoła Zawodowa Kosmetyki i Pielęgnacji Zdrowia w Warszawie.
- Kępa A., Peptydy biomimetyczne i czynniki wzrostu w kosmetologii i medycynie estetycznej. Kosmetologia Estetyczna; 2013, 2, 105-111
- Caragen C.: Biomimetic peptides and growth factors, Research Center, Gyeonggi-do.
- Maquart F.X., Simeon A., Pasco S., Monboisse J.C., Regulation of cell activity by the extracellular matrix: the concept of matrikines. Journal de la Societe de Biologie; 1999, 193, 423- 428.
- Łubkowska B., Kolagen czy peptydy – zadanie dla współczesnej kosmetologii. Laborant; 2013, 6, 14-17.
- Safety Assessment of Palmitoyl Oligopeptides as Used in Cosmetics, Cosmetic Ingradient Review. https://www.cir-safety.org/sites/default/files/palmit072012slr.pdf.
- Reddy B., Jow T., Hantash B.M., Bioactive oligopeptides in dermatology: Part I. Experimental Dermatology; 2012, 21, 569–575.
- Osborne R., Robinson L.R., Mullins L., Raleigh P., Use of facial moisturiuzer containing palmitoyl pentapeptide improves the appreance of aging skin. Journal of the American Academy of Dermatology; 2005, 52 (3 suppl 1): 96.
- Marzec A., Chemia nowoczesnych kosmetyków, Wydawnictwo TONiK „Dom Organizatora”, Toruń, 2010.
- Robinson L.R., Fitzgerald N.C., Doughty D.G., Dawes N.C., Berge C.A., Bissett D.L., Topical palmitoyl pentapeptide provides improvement in photoaged human facial skin. International Journal of Cosmetic Science; 2005, 27, 155-160.
- Hyunju P., Eunjin A., Ae-Ri Cho L., Effect of Palmitoyl-Pentapeptide (Pal-KTTKS) on Wound Contractile Process in Relation with Connective Tissue Growth Factor and α-Smooth Muscle Actin Expression. Tissue Engineering and Regenerative Medicine; 2017, 14(1), 73–80.
- Puig A., Garcia Anton J.M., Mangues M.: A new decorin-like tetrapeptide for optimal organization of collagen fibres. Int J Cosmet Sci 2008, 30, 97-104.
- Foran P.G., Mohammed N., Lisk G.O., Nagwaney S., Lawrence G.W., Johnson E., Evaluation of the therapeutic usefulness of botulinum neurotoxin B, C1, E, and F compared with the long lasting type A: Basis for distinct durations of inhibition of exocytosis in central neurons. Journal of Biological Chemistry; 2003, 278, 1363-1371.
- Hou Y.W., Chan M.H., Hsu H.R., Liu B.R., Chen H.H., Transdermal delivery of proteins mediated by non-covalently associated arginine-rich intrecellular delivery peptides. Experimental Dermatology; 2007, 16, 999-1006.
- Choi S.H., Kim S.Y., An J.J., Lee S.H., Kim D.W. Ryu H.J., Human PEP-1-ribosomal protein S3 protects against UV-inducted skin cell death. FEBS Letters; 2006, 580, 6755-6762.
- Pickart L., Vasquez-Soltero J.M., Margolina A., GHK Peptide as a Natural Modulator of Multiple Cellular Pathways in Skin Regeneration. BioMed Research International; 2015, doi.org/10.1155/2015/648108.
- Pickart L., Margolina A., Regenerative and protective actions of the GHK-Cu peptide in the light of the new gene data. International Journal of Molecule Science; 2018, 19, 1987.
- Pickart L., The human tri-peptide GHK and tissue remodeling. Journal of Biomaterial Science, Polymer Edition; 2008, 19, 969–988.
- Markowska A., Bruzgo I., Miltyk W., Midura-Nowaczek K., Tripeptides with C-terminal arginine as potential inhibitors of urokinase. International Journal of Peptide Research and Therapeutics; 2011, 17, 47–52.
- Padamwar M.N., Pawar A.P., Daithankar A.V., Mahadik K.R., Silk sericin as a moisturizer: an in vivo study. Journal of Cosmetic Dermatology; 2005, 4, 250–257.
- Sudel K.M., Venzke K., Mielke H., Breitenbach U., Mundt C., Jaspers S., Novel aspects of intrinsic and extrinsic aging of human skin: beneficial effects of soy extract. Photochemistry of Photobiology; 2005, 81, 581–587.
- Sivamani R.K., Jagdeo J.R., Elsner P., Maibach H.I., Cosmeceuticals and active ingredients. CRC Press, Taylor & Francis eBooks, London, 2015.


